Abstrakt
Vyvinuli sme jednoduchú a účinnú metódu izolácie fotochemicky aktívnych zlomených chloroplastov z listov ihličnatých stromov, t.j. ihličia a výhonkov, ktorú je možné použiť pre širokú škálu druhov ihličnanov. Využitie tejto metódy vo fotosyntetických štúdiách ponúka možnosť skúmať účinnosť takmer akejkoľvek zložky tylakoidného elektrónového transportného reťazca a odhaliť informácie o jednotlivých častiach primárnych fotosyntetických procesov, ktoré by sa inak ťažko získavali. Rôzne aspekty ovplyvňujúce výsledok tohto postupu, vrátane množstva ihličia potrebného na dostatočnú výťažnosť, možnej dĺžky a podmienok ich skladovania, najlepšieho spôsobu ich rozrušenia, zloženia a pH izolačných a skladovacích pufrov, sekvencie odstreďovania, atď., sú naďalej diskutované.
Úvod
Ihličnaté stromy tvoria hlavnú časť celosvetových lesov, najmä v miernych a subarktických oblastiach. Ich životne dôležitá úloha v globálnom kolobehu uhlíka, regulácii klímy a udržiavaní biodiverzity ich robí predmetom intenzívneho výskumu vykonávaného na rôznych úrovniach – od celého ekosystémového prístupu až po podrobnú analýzu morfológie, fyziológie a bunkovej biológie jednotlivých stromov a ich častí. Merania rôznych fotosyntetických parametrov sú obľúbenou metódou hodnotenia fyziologického stavu stromov, najmä v štúdiách zaoberajúcich sa vplyvom rôznych vonkajších faktorov (zmeny koncentrácie CO2 v atmosfére, abiotické stresory, bylinožravce, choroby a pod.) na ihličnaté stromy, pretože zmena štruktúry/funkcie fotosyntetického aparátu je zvyčajne jednou z prvých reakcií na zmeny prostredia (Ninemets 2010). Poznatky o fotosyntéze ihličnanov boli zhrnuté v niekoľkých článkoch, ktoré sa zaoberali napríklad zmenami parametrov fotosyntézy porastu (Ninemets 2007), reakciou fotosyntetického aparátu na nízku teplotu a svetlo (Adams et al. 2002, Öquist a Huner 2003) alebo zvýšené CO2 (Pinkard et al. 2010).
Stanovenie parametrov fotosyntézy v ihličnatých drevinách však naráža na niektoré špecifické metodické a technické výzvy, najmä pri skúmaní účinnosti primárnych fotosyntetických procesov. V súčasnosti je metódou voľby pre takéto analýzy meranie rôznych parametrov fluorescencie chlorofylu (Chl) pomocou fluorometrov s pulznou amplitúdovou moduláciou alebo fluorescenčných zobrazovacích systémov a práca s jednotlivými stromami. Štandardné prístroje všeobecne používané na takéto merania však nie sú vhodné pre úzky tvar listov ihličnanov a s týmito prístrojmi sa musia použiť špecifické listové kyvety prispôsobené na ihly, aby sa zabezpečili spoľahlivé výsledky. Nestávalo sa to často. Čo je možno dôležitejšie, je skutočnosť, že väčšina bežne vykonávaných hodnotení fluorescencie Chl poskytuje informácie len o stave komplexu fotosystému (PS) II a ostatné časti fotosyntetického reťazca transportu elektrónov (najmä PSI) sú zvyčajne zanedbané.
Alternatívnym prístupom k stanoveniu fotosyntetickej účinnosti rôznych zložiek tylakoidných membrán podieľajúcich sa na prenose elektrónov je meranie ich aktivity v izolovaných chloroplastoch alebo fotochemicky aktívnych tylakoidných membránach. Táto metóda je široko používaná pre mnohé druhy rastlín (hoci s rozvojom fluorescenčných techník Chl sa jej popularita trochu znížila) a je k dispozícii množstvo postupov na izoláciu fotoaktívnych chloroplastov alebo membrán tylakoidov. Izolované chloroplasty možno v podstate klasifikovať ako intaktné (trieda I) alebo zlomené (trieda II vrátane fragmentov chloroplastov a tylakoidných membrán) a rozdeliť ich na niekoľko typov, ktoré sa líšia stavom vonkajších a vnútorných obalových membrán, schopnosťou fixovať CO2, schopnosť penetrácie exogénneho NADP, ferrikyanidu (alebo iných akceptorov elektrónov) a ATP a nutnosť pridania exogénneho ferredoxínu na redukciu NADP (Hall 1972). Typ A („kompletné chloroplasty“) predstavujú neporušené celé chloroplasty so zachovaným vonkajším a vnútorným obalom a vysokou mierou fixácie CO2, typ B („neprerušené chloroplasty“) sú väčšinou podobné typu A, ale ich vonkajší obal je narušený a schopnosť viazať CO2 je nižšia. Chloroplasty typu C sú najčastejšie sa vyskytujúcimi chloroplastmi triedy II; ich vonkajšia obalová membrána sa stráca a zvyčajne nie sú schopné fixovať CO2. Chloroplasty typu D sa získavajú osmotickým šokovým ošetrením chloroplastov typu A; majú schopnosť fixovať CO2 za špecifických podmienok. Posledné dva typy predstavujú fragmenty chloroplastov alebo nepravidelne usporiadané tylakoidné membrány (Typ E) alebo subchloroplastové častice s malými tylakoidnými membránami (Typ F), ktoré nemajú schopnosť fixovať CO2 a líšia sa schopnosťou fotofosforylácie (Hall 1972).
Žiaľ, konvenčné metódy vhodné na izoláciu vysokoaktívnych chloroplastov alebo tylakoidov z bylinných rastlín nie sú zvyčajne použiteľné na ihličnany, pretože izolácia fotoaktívnych chloroplastov z ihličia je oveľa ťažšia z dôvodu vysoko vláknitého charakteru tohto typu listov ( čo komplikuje proces izolácie, pretože je ťažké rozbiť bunky bez poškodenia chloroplastov) a vysoký obsah špecifických zlúčenín (fenoly, živica, tanín atď.), ktoré sa uvoľňujú z vakuoly alebo iných bunkových kompartmentov po rozbití buniek a čo môže viesť k úplnej inhibícii niektorých zložiek fotosyntetického reťazca transportu elektrónov. Pred 40 rokmi bolo publikované značné množstvo prác zameraných na vývoj vhodnej metódy izolácie fotochemicky aktívnych chloroplastov z ihličia ihličnatých stromov, počnúc prácou Oku a Tomita (1971). Skúmalo sa viacero faktorov ovplyvňujúcich účinnosť izolačného postupu a meranie aktivít fotosyntetických komplexov nachádzajúcich sa v tylakoidných membránach a rôzne odporúčania pre zloženie izolačných, skladovacích či meracích pufrov, techniky potrebné na lámanie ihiel a indi- boli uskutočnené vizuálne kroky potrebné na čistenie chloroplastov (Oku a kol. 1971, Lewandowska a kol. 1976, Öquist a kol. 1974, Alberte a kol. 1976, Lewandowska a Öquist 1980). Chloroplasty alebo tylakoidy izolované podľa týchto postupov sa použili napríklad na stanovenie sezónnych zmien vo fotosyntetickom aparáte (Sensor a Beck 1978), alebo vplyvu rôznych vlnových dĺžok a úrovní svetla (Oku a kol. 1974, 1975; Lewandowska a kol. 1976, 1977, Oku a Tomita 1976, Tyszkiewicz a kol. 1979), teplotné podmienky (Martin a kol. 1978) alebo účinky SO2 (Malhotra 1976) na funkciu chloroplastov. Niektoré ďalšie práce podobného typu sa objavili neskôr, väčšinou v 90. rokoch (napr. Oku a Tomita 1980, Afif a kol. 1995, Rashid a Camm 1995, Eastman a kol. 1997), ale sporadicky aj v tomto storočí (Zotíková a kol. Zaitseva 2000, La Porta a kol., 2006, Zhang a kol., 2009). Z väčšej časti však zložitosť izolačných postupov a paralelný masívny nástup fluorescenčných techník Chl viedli k nezaslúženému zanedbaniu týchto metód. Navyše väčšina týchto štúdií bola vykonaná buď so smrekom alebo borovicou; zástupcovia iných rodov ihličnanov boli analyzovaní len zriedkavo (Alberte et al. 1976, La Porta et al. 2006).
Domnievame sa, že hodnota údajov, ktoré možno získať meraním fotosyntetických aktivít v izolovaných chloroplastoch/tylakoidoch (ktoré by sa inak dali získať len ťažko), je taká veľká, že je načase túto metódu získať späť zo zabudnutia a využiť ju. v akejkoľvek štúdii, ktorá je zameraná na podrobnú analýzu fotosyntetických procesov v ihličnatých stromoch. Za týmto účelom sme sa rozhodli prehodnotiť doteraz publikované postupy na izoláciu fotochemicky aktívnych zlomených chloroplastov z ihličia ihličnanov a vyvinúť optimalizovaný a univerzálne použiteľný postup izolácie, ktorý by bolo možné aplikovať na akýkoľvek druh ihličnanov s ihličkovitými listami.
Materiály a metódy
Rastlinný materiál: Väčšina prác potrebných na vývoj uspokojivého postupu izolácie fotochemicky aktívnych zlomených chloroplastov z ihličia sa vykonala na smreku obyčajnom (Picea abies [L.] Karsten). Aby sa zistilo, či je možné náš postup izolácie chloroplastov použiť univerzálne, neskôr bol aplikovaný na 24 ďalších druhov ihličnanov s ihličkovitými listami. Väčšina týchto druhov patrí do čeľade Pinaceae. Preskúmali sme šesť druhov borovíc: borovicu štetinovú (Pinus aristata Engelm.), borovicu sibírsku (Pinus cembra L.), borovicu čiernu európsku (Pinus nigra Arnold), borovicu lesnú (Pinus sylvestris L.), borovicu trpasličiu (Pinus mugo Turra ) a borovica poľná (Pinus contorta Dougl. ex Loudon), štyri druhy smrekov: strieborná odroda modrého smreka (Picea pungens Engelm. [var. argentea]), srbský smrek (Picea omorica [Pančić] Purk.), kaukazský smrek (Picea orientalis [L.] Link) a smrek biely (Picea glauca [Moench] Voss) a štyri druhy jedlí: jedľa koránska (Abies koreana Wils.), jedľa veľká (Abies grandis [Douglas] Lindl.), jedľa biela (Abies concolor [Gordon] Lindl. ex Hildebr.) a jedľa Nikko (Abies homolepis Sieb. Zucc.). Ďalej sme odobrali vzorky aj zo smrekovca (Larix decidua Miller), jedličky (Tsuga canadensis [L.] Carrière), cédra deodarového (Cedrus deodara [Roxb. ex D. Don] G. Don) a cédra libanonského (Cedrus lebani A. Rich). Do našich analýz boli zaradené aj štyri druhy z čeľade Cupressaceae: sekvoja zimná (Metasequoia glyptostroboides Hu & Cheng) a sekvoja pobrežná (Sequoia sempervirens [D. Don] Endl.), cypruštek lysý (Taxodium distichum [L.] L.C.M. Richard) a borievka obyčajná (Juniperus communis L.). Ako zástupcovia čeľade Cephalotaxaceae a Taxaceae boli nakoniec vybrané Harringtonov hlavonožec (Cephalotaxus harringtonia [Knight ex Forbes] K. Koch) a tis obyčajný (Taxus baccata L.).
Z zrelých, vyše 60-ročných stromov (s výnimkou sibírskej borovice, pobrežnej sekvoje a oboch mladších druhov cédrov) pestovaných v Botanickej záhrade UK v Prahe, Prírodovedeckej fakulte, boli odrezané ihličie. (50°04’N, 14°25’E, 210 m n. m.). Pre jeden experiment (zameraný na posúdenie závislosti aktivity PSI na faktoroch spojených s vekom/polohou stromu/ihličia), dospelým (nad 60-ročným) a mladým (8-ročným) smrekom obyčajným pestovaným v Bílom Kříži v Beskydách (49°33′ s. š., 18°32′ v. d., 908 m n. m.). Odber vzoriek smreka obyčajného potrebného na vypracovanie postupu izolácie sa uskutočnil počas leta a začiatkom jesene (jún až september), odber vzoriek ostatných druhov ihličnanov sa uskutočnil v priebehu mája až júna. V oboch prípadoch boli zo vzoriek vylúčené aktuálne ročné ihličie (s výnimkou listnatých druhov ako smrekovec obyčajný, sekvoja zimná a cypruštek lysý, kde bolo potrebné použiť novo vyvinuté ihličie a jeden pokus so smrekom obyčajným zameraný na skúmanie rozdielov medzi súčasnými a staršími ihlami). Každý experiment sa uskutočnil s 3–4 nezávislými vzorkami odobratými z rôznych vetiev (podobne umiestnených) stromu reprezentujúcich príslušný druh.
Izolácia fotochemicky aktívnych zlomených chloroplastov: V priebehu vývoja optimálneho postupu izolácie fotochemicky aktívnych zlomených chloroplastov z ihličia ihličnanov sme skúmali rôzne metodologické aspekty, ktoré by mohli ovplyvniť výsledok, vrátane množstva ihličiek potrebných na dostatočné výťažky, možnú dĺžku a podmienky ich skladovania, najlepší spôsob ich mletia, zloženie a pH izolačného a skladovacieho pufru (tlmivých roztokov) a postupnosť odstreďovania atď. Väčšina týchto experimentov bola založená na predtým publikovaných prácach (tabuľka 1) a ich výsledky a závery z nich sú popísané v sekciách Výsledky a Diskusia tohto článku. Nasleduje opis konečného postupu vyplývajúceho z týchto experimentov.
Ihličky (2,5 g čerstvej hmoty) boli narezané na malé (cca 3–8 mm, v závislosti od ich tvrdosti) kúsky, vložené do 50 cm3 predchladeného (0–4 C) izolačného pufra (400 mM sacharóza, 10 mM NaCl, 5 mM MgCl2, 20 % (w/v) PEG, 50 mM Hepes-NaOH, pH 7,6) a homogenizované v nádobe obklopenej ľadom počas 1 minúty pri 18 000 otáčkach za minútu s použitím homogenizátora OV5 (Velp Scientifica, Miláno, Taliansko) s VSS2CCR2 dispergačný nástroj. Homogenát sa potom prefiltroval cez 8 vrstiev tenkej tkaniny a odstredil sa pri 200 x g počas 2 minút. Supernatant bol opatrne prenesený do inej skúmavky a centrifugovaný pri 500 x g počas 5 minút, výsledný supernatant bol opäť prenesený do čerstvej skúmavky a centrifugovaný pri 6 000 x g počas 10 minút (všetky centrifugačné kroky sa uskutočnili pri 0 °C). Po tomto poslednom kroku sa peleta obsahujúca fotochemicky aktívne chloroplasty resuspendovala v 0,7 až 1,2 cm3 (v závislosti od množstva peliet) skladovacieho pufra (1,2 M sacharóza, 50 mM Hepes-NaOH, pH 6,9) pomocou sklenenej tyčinky s obaleným koncom. v tenkej vrstve vaty. Suspenzia sa preniesla do Eppendorfovej skúmavky a skladovala sa v suchom kúpeli inkubátora (teplota 0 °C) s tmavým krytom. Mikroskopické vyšetrenie suspenzie (fázový kontrast a diferenciálny interferenčný kontrast, Olympus Provis AX70, zväčšenie 400 ×, Olympus Optical Co., Ltd., Tokio, Japonsko) ukázalo, že pozostáva hlavne z rozbitých chloroplastov triedy II (typ C ) podľa nomenklatúry Hall (1972).
Meranie aktivít fotosystémov I a II: Aktivity PSI a PSII boli merané polarograficky pomocou kyslíkovej elektródy Clarkovho typu (Theta´ 90, Praha, Česká republika) vloženej do meracej komory skonštruovanej podľa Bartoša a spol. (1975). Počas všetkých meraní bola v komore udržiavaná konštantná teplota 25 C a reakčné zmesi boli neustále miešané magnetickým miešadlom. Každá reakčná zmes obsahovala 5 cm3 príslušného meracieho pufra, objem (zvyčajne 40–80 mm3) suspenzie rozbitých chloroplastov zodpovedal 7 g Chl (táto hodnota bola zvolená ako optimálna na základe kriviek závislosti aktivity/koncentrácie Chl údaje nie sú uvedené) a umelé akceptory elektrónov, donory a inhibítory jednotlivých krokov fotosyntetického reťazca transportu elektrónov boli pridané v množstvách, ktoré záviseli od typu merania. Obsah Chl v suspenziách bol stanovený spektrofotometricky (Anthelie Advanced 2, Secomam, Lyon, Francúzsko) v 80 % vodnom acetóne (Porra et al. 1989) s riedením chloroplasty/acetón 1/100 (v/v).
Na meranie PSI sa jednotlivé zložky reakčnej zmesi pridali do komory v nasledujúcom poradí: merací pufor (0,4 M sacharóza,
50 mM NaH2P04 H20, pH 6,5), askorbát sodný (konečná koncentrácia 10 mM), DCPIP (konečná koncentrácia 0,25 mM), metyl viologén (konečná koncentrácia 0,1 mM), DCMU (konečná koncentrácia 0,01 mM), NH4Cl (konečná koncentrácia 5 mM) a suspenzia chloroplastov. Skúmali sme tiež mieru spotreby kyslíka bez pridania NH4Cl a s alebo bez azidu sodného (ktorý inhibuje aktivitu endogénnych kataláz). Hodnoty aktivity PSI namerané bez NH4Cl boli nižšie (cca 70 %) v porovnaní s hodnotami nameranými s NH4Cl; keďže tento reaktant slúži ako odpájač svetlom indukovaného toku elektrónov a fotofosforylácie, dospeli sme k záveru, že naše izolované rozbité chloroplasty sú spočiatku v združenom stave. Pridanie 5 mM azidu sodného významne neovplyvnilo namerané hodnoty; táto zložka bola preto z reakčných zmesí vynechaná.
Na meranie PSII sa na začiatku pridal merací pufor (0,4 M sacharóza, 10 mM NaCl, 5 mM MgCl2, 50 mM Hepes-NaOH, pH 6,9) a suspenzia chloroplastov, táto zmes sa nasýtila plynným dusíkom až do koncentrácie kyslíka v komore dosiahli nulu a potom sa pridali KFeCy (konečná koncentrácia 2 mM) a DMBQ (konečná koncentrácia 1 mM). Zásobné roztoky askorbátu sodného, metylviologénu, KFeCy a DMBQ boli čerstvo pripravené každý deň, keď sa robili merania, meracie pufre sa zvyčajne udržiavali v poriadku 3–5 dní, ostatné zásobné roztoky by sa mohli uchovávať niekoľko mesiacov. V prípade DMBQ sa najskôr rozpustil v malom množstve 96% etanolu, následne sa pridalo potrebné množstvo destilovanej vody a roztok sa následne prefiltroval cez gázu.
Výsledky
Vývoj optimálneho postupu na izoláciu fotochemicky aktívnych chloroplastov zo smreka obyčajného: Keďže množstvo ihličia, ktoré je možné získať zo stromov, môže byť často limitujúcim faktorom (najmä pri práci s mladými stromami), testovali sme vzorky pripravené z 1, 1,5, 2, 2,5, 3, 3,5 a 4 g (hmotnosť čerstvej hmoty) ihličiek a určili, že množstvo postačujúce na získanie dobrých výťažkov chloroplastov je 2,5 – 3 g; použitie nižších množstiev zvyčajne viedlo k výraznému zníženiu výťažkov chloroplastov a ich fotochemické aktivity klesli na 40–80 % tých, ktoré sa dosiahli pri použití 2,5 g čerstvej hmoty.
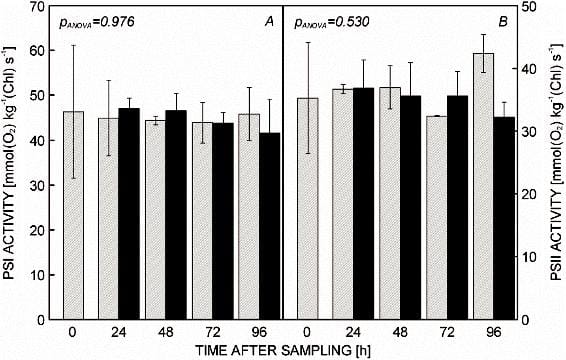
Obr. 1. Aktivity A:
fotosystému (PS) I a B: PSII merané v suspenziách rozbitých chloroplastov izolovaných z ihličiek Picea abies postupom opísaným v tomto článku. Z odobratého stromu sa odrezali malé vetvičky a uskladnili sa v uzavretých polyetylénových vreciach pri 0 °C na rôzne časové obdobia buď ako také, t.j. vetvičky s pripojenými ihličkami (šrafované prúžky), alebo ako ihly odrezali vetvičky (plné tyče). Stredné hodnoty ± SD (n = 4) sú zobrazené spolu s hladinami štatistickej významnosti (určených jednosmernou ANOVA ) rozdielov medzi oboma typmi skladovania a rôznymi časovými obdobiami po odbere vzoriek.
Čo sa týka možnosti práce s rastlinným materiálom skladovaným niekoľko dní, najprv sme skúmali možnosť jeho skladovania v tekutom dusíku (–196 C), v mrazničke (–20 C) alebo v chladničke (4 C) a zistili sme že kým skladovanie v tekutom dusíku alebo v mrazničke vedie takmer okamžite k totálnej strate aktivít PSI a PSII, skladovanie v chladničke do 96 hodín nemá na hodnoty týchto parametrov významný vplyv (obr. 1) . Testovali sme aj to, či je lepšie skladovať vetvičky s nasadeným ihličím alebo neprichytené ihličie odrezať vetvičky a zistili sme, že aktivity sa v týchto dvoch prípadoch výrazne nelíšia (s výnimkou aktivity PSII po 96 hodinách skladovania pri 4 C, ktorá vo vzorkách izolovaných z odrezaných ihiel (obr. 1).
Počas prvého kroku izolačného postupu musia byť ihly pomerne jemne nalomené, aby sa uvoľnil obsah buniek, a potom sa musí odstrániť hrubá hmota. Na základe niektorých predchádzajúcich prác iných autorov sme sa pokúsili lámať ihly v brúsiacej mažiari s malým množstvom izolačného pufra (s prídavkom aj bez prídavku tekutého dusíka), ale takýto postup bol časovo veľmi náročný a poskytoval iba zanedbateľné množstvo použiteľného materiálu. Preto sme sa rozhodli použiť homogenizátor typu mixér a po testovaní dvoch takýchto prístrojov (Thurmix 302, MPW, Varšava, Poľsko a OV5, Velp Scientifica, Miláno, Taliansko), rôzne dĺžky procesu homogenizácie (20, 30, 40 , 60, 80, 100, 120, 150 a 180 s) a rôzne rýchlosti homogenizátora (14 000; 15 000; 18 000; a 22 000 ot./min.), sme zvolili 1 minútu pri 18 000 ot./min. ako optimálny typ homogenizátora s použitím väčšiny parametrov homogenizátora OV5 ihiel.
Po homogenizácii ihiel a filtrácii homogenátu cez tenkú tkaninu bolo ďalším krokom odstránenie zvyšných fragmentov bunkových stien a iných nepotrebných bunkových zložiek následnými centrifugáciami pri nízkej rýchlosti. Aby sme našli najlepší postup pre tento krok, testovali sme rôzne kombinácie parametrov odstreďovania a izolačných/skladovacích pufrov odporúčaných predchádzajúcimi autormi (tabuľka 1), ako aj niektoré parametre kombinované z dvoch alebo viacerých prác a nakoniec sme dosiahli postup ktorý je popísaný v časti Metódy tohto dokumentu. Potom sme porovnali aktivity PSI a PSII merané v suspenziách rozbitých chloroplastov izolovaných nami preferovaným postupom s aktivitami meranými v chloroplastoch, ktoré sme izolovali 20 ďalšími predtým opísanými metódami a zistili sme, že keď sa berú do úvahy aktivity PSI aj PSII, náš postup prináša najlepšie výsledky (tabuľka 2). Aj keď v niektorých prípadoch boli hodnoty aktivity PSI v chloroplastoch izolovaných inými postupmi vyššie, zodpovedajúce aktivity PSII boli zvyčajne oveľa nižšie a naopak. Iba centrifugačný postup/zloženie pufra opísané Oku a Tomita (1980) viedli k hodnotám oboch aktivít porovnateľným s hodnotami stanovenými v rozbitých chloroplastoch izolovaných naším postupom a aj vtedy „ich“ metóda poskytovala PSII aktivitu čo bolo o niečo nižšie ako naša metóda (tabuľka 2).
Tiež sme testovali, či si chloroplasty izolované naším postupom dokážu udržať svoju aktivitu niekoľko hodín (čo je potrebné na analýzu veľkého počtu vzoriek), a potvrdili sme, že je to skutočne tak a že aktivity PSI aj PSII zostávajú zachované. nezmenené aspoň 7 hodín (s variačnými koeficientmi 5,3 %, resp. 4,0 %, pre aktivitu PSI, resp. PSII), čo by malo byť dostatočné na väčšinu účelov. Zároveň sme zistili, že použitie DMBQ ako umelého akceptora elektrónov na stanovenie aktivity PSII vyžaduje prípravu čerstvého roztoku každé 2 hodiny, keďže sme zažili cca. 10% strata jeho elektrón-akceptorových vlastností po tomto čase. Na meranie aktivity PSII sme skúšali aj iné koncentrácie/kombinácie umelých akceptorov elektrónov, ale výsledné hodnoty boli vždy výrazne nižšie v porovnaní s hodnotami nameranými pri kombinácii 2 mM KFeCy a 1 mM DMBQ, ktoré odporúčame (len 26,0 % pre kombináciu 1,2 mM KFeCy a 0,5 mM PD, 41,4 % pre kombináciu 7 mM KFeCy a 0,5 mM PD, 74,6 % pre 1 mM DMBQ a 39,9 % pre 7 mM).
Tabuľka 1. Stručný opis postupov izolácie chloroplastov/tylakoidov, ktoré boli porovnané s postupom navrhovaným v tomto článku. Homogenizácia prebiehala vždy v 50 cm3 príslušného tlmivého roztoku a výsledný homogenát sa následne prefiltroval cez 8 vrstiev tenkej tkaniny. V prípade, že boli predpísané niektoré následné centrifugácie, peleta sa vždy resuspendovala (pomocou sklenenej tyčinky obalenej vatou) v 1 cm3 príslušného pufra a tento pufor sa potom pridal do konečného množstva 30 cm3 (pokiaľ nie je uvedené inak). Peleta po záverečnej centrifugácii bola zvyčajne resuspendovaná v 0,7–1,2 cm3 príslušného pufra v závislosti od jej výťažku. Druhy použité v pôvodných štúdiách popisujúcich tieto postupy sú uvedené v zátvorkách v stĺpci Referencie/Druhy (* rôzne ihličnany skúmané v štúdii Alberte et al. (1976) boli: Pinus pinea, P. radiata, P. canariensis, P. taeda, Cedrus atlantica, Picea pungens cv. Glauca, Taxodium distichum a Metasequoia glyptostroboides).




