Prehľad tradičného používania, botanika, fytochémia, biologická činnosť a toxikológia Tropaeolum majus L. – A
ÚVOD
Využívanie prírodných produktov, najmä flóry, na terapeutické účely je prastará prax prenášaná medzi po sebe nasledujúcimi generáciami (Andrade et al ., 2007). Ako ilustrujú liekopisy z 19. storočia, terapeutické zdroje pozostávali predovšetkým z rastlinných extraktov. Súbežne s pokrokom medicíny sa na prelome dvadsiateho storočia začala izolácia aktívnych zložiek odvodených zo surových rastlinných materiálov (Veiga et al ., 2005).
Napriek veľkému pokroku alopatickej medicíny v posledných rokoch zostávajú rastliny stále dôležitou alternatívou podpory zdravia. Toto je pozorované v dôsledku prekážok pri používaní tradičnej medicíny (Ouedraogo et al., 2012). V krajinách, kde je moderná zdravotná starostlivosť obmedzená alebo nedostupná, sa často používa tradičné používanie liečivých rastlín (Agra et al ., 2007).
Údaje uvedené nižšie boli získané po výskumoch s použitím databáz SciELO, PubMed, ScienceDirect a Portal da Capes.
Botanika
Tropaeolum majus L . je jednoročná a rýchlo rastúca rastlina, ktorá patrí do čeľade Tropaeolaceae, v Brazílii hovorovo nazývaná chaguinha, capuchinha a nastúrcio (Lorenzi & Matos, 2002). Pôvodne od Peru po Mexiko, je schopný rásť v mnohých častiach sveta vďaka svojej rustikálnosti a prispôsobivosti (Panizza, 1997). Stonka je mäkká, kľukatá, dlhá a mäsitá. Jeho listy sú zaoblené, zelenomodrej farby a fixované spodnými časťami stredu stoniek. Kvety sú hermafroditné, zygomorfné, nápadné, zúžené a izolované pozdĺž stopky, zatiaľ čo koruna je päťpočetná so sfarbením od žltej po tmavočervenú. Kalich je na vrchole rozdelený na päť kališných lístkov a plody tvoria tri malé nažky, zelenkastej farby (Ferri et al .., 1981; Silva a kol ., 2009). Každý plod obsahuje tri semená, ktoré padajú na zem a spontánne vyklíčia (Ortiz de Boada & Cogua, 1989).
Mikroskopická analýza listov ukázala, že epidermis je jednoradová a amfistomatická. V abaxiálnej epiderme sú bunky menšie, vinutie je výraznejšie a vyskytujú sa jednoradové žľazové chĺpky s 3-6 bunkami a zúženými koncami. Anomo a anizocytické prieduchy sú xerofytické a substomatálne
kamera je väčšia v adaxiálnej epiderme. Mezofyl má nevrstvený palisádový parenchým a hubovitý parenchým tvorený 5-6 vrstvami okrúhlych buniek s priestorovými medzerami. Mikroskopická analýza kôry tiež ukázala hrubú kutikulu. Epikutikulárne formácie a epidermálne bunky majú tendenciu byť pravouhlé. Cholenchým (uhlový typ) je tvorený dvoma vrstvami buniek pod epidermou. Xylém má parenchymatózne bunky a kostná dreň je hlavnou časťou stonky (Zanetti et al., 2004).
Fytochémia
Existuje mnoho chemických zložiek izolovaných z T. majus, vrátane polyfenolov, glukosilonátov a mastných kyselín. V tejto časti popisujeme hlavné chemické zložky tejto rastliny.
Flavonoidy
Z T. majus bolo izolovaných niekoľko flavonoidov . Koriem et al analyzovali flavonoidy prítomné v listoch a kvetoch metylalkoholového extraktu T. majus pomocou kvapalinovej chromatografie/hmotnostného spektra (LC/MS). Výsledky ukázali väčšie množstvo glukozidu kempferolu (9,40 mg/100 ml extraktu), po ktorom nasledoval izoquercitrozid (2,25 mg/100 ml extrakt) a kvercetol 3-triglukozid (1,17 mg/100 ml extrakt) (Koriem et al ., 2010 ). Použitím elektrosprejovej ionizačnej hmotnostnej spektrometrie (ESI-MS) a vysokoúčinnej kvapalinovej chromatografie (HPLC-UV) na analýzu extraktov listov Gasparotto a kol.(2011a) získané ako hlavné zložky frakcie eluovanej vodou a etanolom, izokvercitrín a glukozid kempferolu (Gasparotto et al ., 2011a).
Bazylko a kol. (2013) preukázali prítomnosť kvercetín-3-O-glukozidu (izokvercitrín) a kaempferol-3-O-glukozidu (astragalínu) vo vodnom extrakte z byliny T. majus . Taktiež bola zistená prítomnosť derivátov kvercetínu a kaempferolu (Bazylko et al ., 2013). V ďalšej práci z tej istej výskumnej skupiny bol zistený vyšší obsah flavonoidov v hydroetanolovom extrakte a vodnom extrakte z listov a kvetov (26,0 mg/g, resp. 15,2 mg/g), nasledovaný bylinkovou šťavou (11,2 mg/g). g). Podobným spôsobom bol obsah celkových fenolov 35,6 mg/g v hydroetanolovom extrakte a 29,5 mg/g vo vodnom extrakte, po ktorom nasledovala bylinková šťava (19,5 mg/g) (Bazylko et al ., 2014).
Izoquercitrín je prírodný flavonoidový glukozid, analóg kvercetínu, o ktorom sa zistilo, že má široké spektrum biologických vlastností (Razavi et al ., 2009), ako je diuretický účinok; protizápalové pôsobenie; antioxidačná aktivita, zníženie hladiny ROS; zníženie schopnosti peroxidácie lipidov a inhibícia diferenciácie adipocytov (Rogerio a kol ., 2007; Gasparotto a kol ., 2011a; Li a kol ., 2011; Lee a kol .., 2011). Lipidová peroxidácia je reťazová reakcia polynenasýtených mastných kyselín bunkových membrán, ktoré podliehajú zmenám v permeabilite, tekutosti a integrite v dôsledku produkcie voľných radikálov. Tieto poškodené bunky sú predisponované k dobre známym komorbiditám, ako je systémová arteriálna hypertenzia, dyslipidémia, tromboembolické príhody, diabetes mellitus a rakovina (Mahattanatawee et al ., 2006). Mnohé flavonoidy sú antioxidanty, preto niektoré zlúčeniny nachádzajúce sa v T. majus môžu pôsobiť ako prevencia bunkovej degenerácie (Bohm a kol ., 1998). Napríklad kaempferol pôsobí ako zachytávač protónových radikálov (test zachytávania DPPH), zachytávač hydroxylových radikálov (test degradácie deoxyribózy) a chelatačné činidlo kovov (Singh et al ., 2008).
Glukosilonáty
Glukosilonáty sú hydrofilné zlúčeniny, ktoré sú chemicky a tepelne stabilné. K jeho hydrolýze dochádza v dôsledku enzymatickej reakcie sprostredkovanej endogénnym enzýmom myrozinázou (ß-tioglukozidáza). Tento enzým sa vyskytuje v rastlinách obsahujúcich glukosilonáty, ale v oddelených kompartmentoch. Keď sa tkanivo poškodí, napr. pôsobením húb, žuvaním alebo rezaním, glukosilonáty sa dostanú do kontaktu s myrozinázou, čím sa uvoľní benzylizotiokyanát (Bones & Rossiter, 1996).
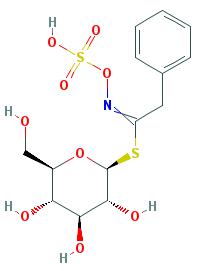
Hlavné glukozilonáty nachádzajúce sa v T. majus sú glukotropaeolín (obrázok 1) a sinalbín. Koriem a kol . získali obe zložky z listov a kvetov metylalkoholového extraktu T. majus (1,65 mg glukotropaeolínu/100 ml extraktu a 12,54 mg sinalbínu/100 ml extraktu) (Koriem a kol ., 2010). Použitím metódy HPLC Bazylko a kol. (2013) tiež preukázali prítomnosť glukotropaeolínu v hydroetanolickom extrakte T. majus získanom pri 90 °C (Bazylko et al .., 2013). Zaujímavé je, že v inej práci z tej istej skupiny analýza ukázala nedostatok glukotropaeolínu vo vodnom extrakte a šťave. Okrem toho boli pozorované iba stopy glukotropaeolínu v hydroetanolovom extrakte (Bazylko et al ., 2014).
Koriem a kol. (2010), dávkoval benzylizotiokyanát v metylalkoholovom extrakte z listov a kvetov T. majus, čím sa získalo 20,24 mg/100 ml extraktu (Koriem et al ., 2010). Benzylizotiokyanát má dôležité fyziologické úlohy. Stimuluje chemoprotektívne mechanizmy, ale v závislosti od koncentrácie môže vyvolať aj bunkový stres. Pôsobia ako induktory enzýmov fázy 2 detoxikačného mechanizmu a inhibujú enzýmy fázy 1, čím zvýraznia výkonnosť buniek pri chemickej detoxikácii. Štúdie in vitro tiež preukázali antimikrobiálne a antihelmintické účinky. Okrem toho má dôležitú protirakovinovú funkciu, zvyšuje výskyt apoptózy rakovinových buniek (Kermanshai et al .., 2001; D’agostini a kol ., 2005; Morant a kol ., 2008; Volden a kol ., 2008; Sofrata a kol ., 2011).
Mastné kyseliny
Koriem a kol. (2010), dávkovali obsah mastných kyselín v listoch a kvetoch metylalkoholového extraktu T. majus pomocou kvapalinovej chromatografie/hmotnostného spektra (LC/MS). Fytochemický skríning ukázal vyššiu koncentráciu kyseliny linolovej (1,18 mg/100 ml extraktu), následne kyseliny olejovej (0,71 mg/100 ml extraktu) a kyseliny erukovej (0,22 mg/100 ml extraktu) (Koriem et al ., 2010) .
Esenciálne mastné kyseliny, olejová a linolová, majú pre organizmus dôležité funkcie. Môžu pomôcť predchádzať srdcovým chorobám, znižovať zrážanlivosť krvi, potláčať tvorbu rakoviny, potláčať široké spektrum alergických mediátorov a vykonávať neuroprotektívne pôsobenie, okrem iného (Chin a kol ., 1992; Bemelmans a kol ., 2002; Martínez-González & Bes-Ratrollo, 2006).
Kyselina olejová sa nazýva omega 9 kyselina. Podieľa sa na ľudskom metabolizme ako antioxidant a hrá zásadnú úlohu pri syntéze hormónov (Bressan et al ., 2009).
Tiež kyselina linolová, nazývaná ako kyselina omega 6. Je to prekurzor kyseliny arachidónovej, ktorý má dôležitú úlohu pri produkcii radu lipidových mediátorov, eikosanoidov, ktoré sú syntetizované prostredníctvom kaskády kyseliny arachidónovej (James et al ., 2000). Je potrebné udržiavať bunkové membrány, mozgové funkcie a prenos nervových vzruchov za normálnych podmienok. O týchto mastných kyselinách je známe, že sa podieľajú na prenose vzdušného kyslíka do krvnej plazmy, delení buniek a syntéze hemoglobínu (Youdim et al ., 2000).
Ostatné zložky
Okrem už vyššie uvedených zlúčenín boli opísané ďalšie zložky T. majus, vrátane karotenoidov, terpenoidov, kyseliny askorbovej, antokyanov, esterov kyseliny chinovej so škoricovými kyselinami (kyseliny chlorogenové a kyseliny p-kumaroylchinové), cukru a minerálov ( Harbone, 1963; Ferri a kol ., 1981; Niizu & Rodriguez-Amaya, 2005; Garzón & Wrolstad, 2009; Bazylko a kol ., 2013).
Podľa Niizu a Rodriguez-Amaya (2005) bolo v kvetoch T. majus identifikovaných osem karotenoidov : violaxantín, antheraxantín, luteín, zeaxantín, zeinoxantín, β-kryptoxantín, α-karotén a betakarotén. V žltých kvetoch sa zistilo 450 µg/g luteínu, stopy violaxantínu a β-karoténu, kým neoxantín sa nenašiel. V pomarančových kvetoch sa zistilo 350 µg/g luteínu, tiež stopy violaxantínu a β-karoténu a nezistili sa hladiny neoxantínu. Zaujímavé je, že v listoch sa nameralo 136 ug/g luteínu, 74 ug/g violaxantínu, 69 ug/g β-karoténu a 48 ug/g neoxantínu (Niizu & Rodriguez-Amaya, 2005).
Výťažok obsahu antokyanov v T. majus nie je známy. Harbone sa pokúsil ohlásiť hlavný pigment prítomný v okvetných lístkoch pomaranča kvetov T. majus ako pelargonidín 3-soforozid (Harbone, 1963). Garzón a Wrolstad (2009) dávkovali obsah antokyánov v okvetných lístkoch pomarančových kvetov T. majus a našli 72 mg antokyanov/100 g kvetov (Garzón & Wrolstad, 2009). Prostredníctvom analýzy Sudan III bola tiež charakterizovaná prítomnosť esenciálnych olejov vo všetkých parenchymatických formáciách (Zanetti et al ., 2004). Olej produkovaný semenami, známy po celom svete ako Lorenzov olej, sa používa na liečbu ťažkých a
degeneratívne ochorenie nazývané adrenoleukodystrofia (Carlson & Kleiman, 1993).
Biologická aktivita
Vďaka širokému spektru biologických a farmakologických účinkov sa T. majus dlhé roky používa ako tradičný liek. Výskumníci ako také testovali surové extrakty a frakcie na rôzne biologické aktivity. Niektoré z týchto štúdií sú diskutované nižšie.
Tradičné zvyklosti
Populárne sa používa ako antiseptikum, diuretikum, preháňadlo,
vlasové tonikum, antiskorbutikum, protizápalové, antihypertenzívne a antidepresívne. Okrem toho sa používa pri čistení kože, očí a pri liečbe kožných porúch, furunkulózy, akné, pľúcnych porúch, amyotrofickej laterálnej sklerózy, psoriázy, ekzému a skrofule (Boorhem, 1999; Lorenzi & Matos, 2002; Ferreira et al ., 2004; Lourenço a kol ., 2011; Messias a kol ., 2015). Okrem toho je táto rastlina široko pestovaná na okrasné účely a má príjemnú vôňu a korenistú chuť, podobnú vlastnostiam, ktoré má žerucha. Vďaka svojej vysokej nutričnej hodnote, obzvlášť bohatej na síru, sa jej listy, kvetinové gombíky a kvety používajú v šalátoch (Bown, 1995; Panizza, 1997; Boorhem, 1999; Vaz & Jorge, 2006).
Diuretický účinok a jeho mechanizmy
Niekoľko štúdií, in vitro aj in vivo, preukázalo diuretický účinok T. majus (Binet, 1964; Goos a kol ., 2006; Barboza a kol ., 2014).
Gasparotto a kol. (2011a) testovali diuretický účinok poločistenej frakcie získanej z hydroetanolového extraktu (TMLR) listov T. majus a jeho zložky, flavonoidu izoquercitrínu. Liečba jednou dávkou TMRL (100 mg/kg) významne zvýšila diurézu po 6, 8, 15 a 24 hodinách. Celkový objem moču nameraný po 6 a 24 hodinách u zvierat liečených TMRL bol 2,22 ml a 3,97 ml, zatiaľ čo výdaj moču v kontrolnej skupine v rovnakých časoch bol 1,02 ml a 2,53 ml, v tomto poradí. Jednorazové podanie izokvercitrínu (10 mg/kg) tiež zvýšilo diurézu v porovnaní s kontrolnou skupinou. Objem moču po 4 hodinách bol 1,63 ml v skupine s izokvercitrínom oproti 0,85 ml v kontrolnej skupine (Gasparotto et al .., 2011a).
/267
Hodnotili sa aj účinky akútnej liečby hydrochlorotiazidom (HCTZ), TMRL (100 mg/kg) a izokvercitrínom (10 mg/kg) na hladiny elektrolytov. Všetky testované látky zvýšili vylučovanie Na +, avšak iba skupina HCTZ vykazovala vysoké množstvá K + v moči. Študoval sa aj dôsledok dlhších časov liečby, denné podávanie TMLR (100 mg/kg) a izokvercitrínu (10 mg/kg) počas 7 dní významne zvýšilo diurézu po prvom dni liečby, takže kumulatívny prietok moču sa zvýšil z 2,53 ml u kontrolných zvierat na 3,97 ml a 4,58 ml u potkanov liečených TMLR a izoquercitrínom, v danom poradí. Okrem toho sa vylučovanie Na + v moči zvýšilo pri oboch ošetreniach v dňoch 1, 5, 6 a 7, ale K+ úrovne zostali nezmenené.
Skupina s hydrochlorotiazidom významne zvýšila vylučovanie K + močom. Autori pripisujú diuretickú aktivitu najmä prítomnosti izokvercitrínu vo frakcii TMRL (Gasparotto et al ., 2011a).
Ďalšia práca z tej istej výskumnej skupiny testovala diuretický účinok po perorálnom podaní etanolového extraktu z listov T. majus (HETM), jeho purifikovanej frakcie (TMLR) a izokvercitrínu (ISQ), porovnávajúc výsledky s liekmi známymi ako
diuretiká (furosemid/FURO, hydrochlorotiazid/HCTZ, acetazolamid/ACTZ a spironolak-ton/SPIRO). Výstup moču nameraný v skupinách HETM, TMLR a ISQ bol podobný ako v skupinách ACTZ, SPIRO a FURO a o niečo nižší ako v skupine HCTZ. V porovnaní s extraktmi T. majus (HETM a TMLR) vykazovali zvieratá liečené HCTZ vyššie množstvá Na + v moči. Liečba ACTZ a HCTZ zvýšila vylučovanie K + močom o 72 % a 88 %. Tento parameter zostal nezmenený u zvierat liečených extraktmi T. majus a skupín ISQ. Cl v močivylučovanie bolo 12,48 mmol/l/15 h v skupine SPIRO (50 mg/kg), 12,35 mmol/l/15 h v skupine TMLR (100 mg/kg), 11,20 mmol/l/15 h v skupine HETM ( 300 mg/kg) a 10,31 mmol/l/15 h pre kontrolnú skupinu. Namerané hodnoty však boli značne odlišné pre FURO 10 mg/kg (26,33 mmol/l/15
- a HCTZ 10 mg/kg (20,17 mmol/l/15 h) (Gasparotto et al ., 2012).
Podľa autorov všeobecný profil diuretického účinku naznačuje, že účinok extraktov T. majus a ISQ sú blízke účinku vyvolanému
spironolaktónom. Diuretický účinok pripisujú aj inhibícii enzýmu konvertora angiotenzínu a následnému zvýšeniu biologickej dostupnosti bradykinínu, PGI2 a oxidu dusnatého. So zvýšenou diurézou môže súvisieť aj inhibičný účinok na Na + /K + -ATPázu . Podobne ako pri spironolaktóne, zníženie sérového aldosterónu spojené s hypotenzným účinkom môže zvýšiť hydrostatický tlak v renálnych arteriolách, čo je zodpovedné za pozorované diuretické a natriuretické účinky. Nízke množstvá draslíka a/alebo iných kovov boli pozorované u T. majus, čo viedlo autorov k odmietnutiu možnosti, že by osmotický mechanizmus mohol súvisieť s diuretickým účinkom (Gasparotto et al .., 2012).
Antihypertenzívny účinok
Gasparotto a kol. (2011b), testovali antihypertenzívne účinky izoquercitrínu, hydroetanolových extraktov T. majus(HETM) a semipurifikovaná frakcia (TMLR). Po 1,5 hodine perorálnej liečby HETM 10 a 300 mg/kg sa stredný bazálny arteriálny tlak (MAP) u normotenzných potkanov znížil o ~13 mm Hg spôsobom závislým od dávky a času. Podobne, perorálne podanie TMLR 12,5 a 100 mg/kg spôsobilo hypotenzívne účinky s hodnotami zníženia 17,94 a 20,77 mm Hg, v danom poradí. Žiadna z liečebných metód však nedokázala znížiť srdcovú frekvenciu. Analýzou hypotenzných účinkov izokvercitrínu u normotenzných potkanov štúdia ukázala, že intravenózne podanie izokvercitrínu (0,5 – 4 mg/kg) mohlo spôsobiť zníženie MAP (spôsob závislý od dávky) s menším vplyvom na srdcovú frekvenciu. Intraduodenálna liečba s TMLR (50 mg/kg) a HETM (100 mg/kg) vykazovala antihypertenzívne a hypotenzívne účinky,a kol ., 2011b).
Pokiaľ ide o meranie sérového angiotenzín konvertujúceho enzýmu (ACE), perorálne podávanie HETM (0 – 300 mg/kg), TMLR (25 – 100 mg/kg) a izokvercitrínu (5 – 10 mg/kg) dokázalo znížiť sérová aktivita ACE o 20 % a 24 % pri 100 a 300 mg/kg HETM, v danom poradí. Potkany liečené TMRL v dávke 50 a 100 mg/kg vykazovali zníženie aktivity ACE o 28 % a 30 %. Štúdia ďalej ukázala, že intravenózne podanie izokvercitrínu (4 mg/kg) spôsobilo 34 % zníženie hypertenznej odpovede angiotenzínu I u normotenzných potkanov a
/268
nemal významný vplyv na hypotenzívne účinky bradykinínu. Autori uvádzajú, že zníženie krvného tlaku nemôže priamo súvisieť so žiadnym srdcovým účinkom, pretože po hypotenzii, ktorá bola overená po liečbe HETM a TMLR, nenasledovalo významné zníženie srdcovej frekvencie testovaných zvierat. Tiež predpokladajú, že hypotenzný účinok by mohol súvisieť s izokvercitrínom prítomným v T. majus (Gasparotto et al ., 2011b).
Antimikrobiálna aktivita
Benzylizotiokyanáty sú uznávané ako potenciálne antimikrobiálne látky (Masuda a kol ., 2009; Jang a kol ., 2010; Sofrata a kol ., 2011; Dufour a kol ., 2012). Bazylko et al. testovali aktivitu bylinných extraktov T. majus (vodných a hydroetanolických) proti Staphylococcus aureus, Bacilus subtilis, Micrococcus luteus, Escherichia coli, Pseudomonas aeruginosa a Bordetella bronchiseptica . Antimikrobiálna aktivita nebola zistená a autori ju korelujú s nízkym obsahom benzylizotiokyanátu v extraktoch (Bazylkoa kol ., 2013).
Na druhej strane, antimikrobiálna aktivita frakcií etanolového extraktu T. majus bola stanovená bioautografiou s použitím gram-pozitívnych a gram-negatívnych baktérií, okrem amoxicilínu ako pozitívnej kontroly. Výsledkom bolo, že hexánové a chloroformové frakcie predstavovali inhibičné zóny pre všetky testované mikroorganizmy ( Staphylococcus epidermidis, Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae a Salmonella setubal ) (Zanetti et al ., 2003).
Antioxidačná aktivita
Niektoré štúdie skúmali antioxidačné pôsobenie T. majus (Machado, 2008; Bazylko et al ., 2013; Vieira, 2013). Na pomarančových kvetoch Garzón a Wrolstad (2009) testovali antioxidačnú kapacitu T. majus pomocou metódy opísanej v Re et al. (1999) a aktivita zachytávania voľných radikálov DPPH podľa metódy opísanej Hsu et al. (2006). Výsledky ukázali, že pomarančové kvety T. majus boli schopné uhasiť radikály ABTS a DPPH, pričom aktivita zachytávania radikálov ABTS bola vyššia ako aktivita zachytávania radikálov DPPH (Re et al ., 1999; Hsua kol., 2006; Garzon & Wrolstad, 2009).
Bazylko a kol. (2014) stanovili antioxidačnú aktivitu T. majus analýzou vodných a hydroetanolových extraktov listov a kvetov a čerstvej bylinkovej šťavy prostredníctvom aktivity zachytávania radikálov DPPH a vyhodnotením
Produkcia ROS v bunkovom modeli chemiluminiscenciou a oxidáciou ľudských neutrofilov. Testované extrakty a šťava mali nízku aktivitu zachytávania DPPH pri koncentrácii 100 ug/ml, čo je 24,1 %, 37,5 % a 34,7 % pre vodný extrakt, hydroetanolický extrakt a šťavu. Pokiaľ ide o tvorbu ROS, extrakty vykazovali silnejšiu antioxidačnú aktivitu proti H2O2 a O2 –, zatiaľ čo šťava vykazovala významnú aktivitu iba proti O2 – . V ex vivo modeli oxidácie ľudských neutrofilov hydroetanolový extrakt vykazoval silnejšiu inhibíciu produkcie ROS a vodný extrakt vykazoval slabší inhibičný účinok. Najslabšia aktivita však bola pozorovaná pri šťave (Bazylko et al., 2014).
Iné akcie
Ochranné účinky na krv a pečeň potkanov proti toxicite dietylmaleátu, liečbe skorbutu, antitrombínovej aktivite a prevencii proti makulárnej degenerácii boli pozorované kvôli karotenoidom nachádzajúcich sa v rastline (Niizu & Rodriguez-Amaya, 2005; Santo et al ., 2007 Koriem a kol ., 2010). V hormonálnom systéme hydroetanolový extrakt získaný z listov T. majus neovplyvňuje ex vivo kontraktilitu maternice gravidných potkanov vyvolanú oxytocínom alebo kyselinou arachidónovou. Okrem toho nemá in vivo estrogénovú alebo antiestrogénnu aktivitu, čo naznačuje, že T. majus nemoduluje estrogénové odpovede in vivoa nemá vplyv na kontraktilitu maternice. Nie je tiež schopný vyvolať androgénne aktivity, blokovať účinky testosterónu na tkanivá citlivé na androgény, ako je prostata, semenný vačok, žaluď penisu a sval levator ani/bulbocavernosus (Lourenço et al., 2012). Tiež z vodných a hydroetanolových extraktov T. majus, Bazylko et al. (2013), skúmali potenciálnu protizápalovú aktivitu a hodnotili inhibíciu cyklooxygenázy 1 (COX1) a hyaluronidázy. Všetky extrakty vykazovali inhibíciu aktivity cyklooxygenázy 1, pričom extrakty z lyofilizovaných bylín vykazovali silný účinok pri koncentrácii 50 ug/ml, čo je účinok porovnateľný s účinkom 2 uM indometacínu. Žiadny z extraktov však nepôsobil ako inhibítory hyaluronidázy (Bazylko et al., 2013).
Toxicita
Množstvo správ o toxicite T. majus ukazuje na bezpečné použitie, s výnimkou tehotenstva.
Zanetti a kol. (2003) testovali akútnu toxicitu vodných a hydroetanolových extraktov z listov a kôry T. majus na myšiach pomocou metódy, ktorú opísal Brito (1994). Pri dávkach: 625, 1250, 2500 a 5000 mg/kg extrakty nevykazovali žiadne známky toxicity, ako sú úmrtia, depresia, vzrušenie, kŕče, slinenie, piloerekcia, slzenie, poruchy defekácie alebo účinky na dýchanie a pohyb ( Zanetti a kol., 2003; Brito, 1994). Podobne ako výsledky získané Gasparottom a kol. (2009), v ktorej sa nezistili žiadne známky akútnej toxicity u samcov a samíc potkanov po perorálnom podaní T. majushydroetanolový extrakt v dávke 5000 mg/kg alebo intraperitoneálne v dávkach 1000 a 3000 mg/kg (Gasparotto et al., 2009).
Prostredníctvom hydroetanolového extraktu z listov T. majus, Gomes et al. (2012) hodnotili orálnu subchronickú toxicitu u potkanov Wistar. Príznaky toxicity, ako je hnačka, piloerekcia, triaška, slinenie a kŕče, neboli pozorované. Taktiež žiadne zo zvierat nezomrelo počas 28 dní liečby dávkami: 75, 375 a 750 mg/kg alebo vehikulom. V žiadnej zo skupín neboli pozorované žiadne štatistické rozdiely v relatívnej hmotnosti pečene, obličiek alebo sleziny. Okrem toho výsledky naznačujú absenciu hematologických a biochemických porúch. Okrem toho žiadne histopatologické zmeny nesúviseli s liečbou. Tieto výsledky naznačujú absenciu orálnej toxicity v dôsledku subchronickej liečby T. majus (Gomes a kol., 2012).
Na druhej strane, Lourenço a spol. (2014) študovali vplyv hydroetanolového extraktu z listov T. majus (HETM) na embryonálny vývoj pri podávaní gravidným potkanom počas obdobia jednobunkovej blastocysty, ktoré zahŕňa fázy tubálneho tranzitu a implantácie. Hoci sa nepozorovali žiadne známky toxicity pre matku, denná liečba HETM v dávkach 300 mg/kg významne zvýšila sérové hladiny dehydroepiandrosterónu (DHEA) aj estradiolu, zatiaľ čo progesterón nebol ovplyvnený. Je známe, že zvýšené hladiny DHEA môžu spôsobiť silný nárast zlyhania implantácie embrya tým, že interferujú s
správny rast, vývoj a diferenciácia endometria na decidua. Schopnosť extraktu z T. majus zvýšiť koncentráciu tohto hormónu teda môže súvisieť so znížením správnej implantácie embrya v skorých štádiách tehotenstva, čím ju inhibuje (Lourenço et al., 2014).
ZÁVERY
Flavonoid isoquercitrin, izolovaný z extraktov T. majus, vykazoval široké spektrum biologických účinkov, vrátane diuretického, antioxidačného a antihypertenzívneho účinku. Ďalší izolovaný flavonoid, kaempferol, tiež preukázal antioxidačnú aktivitu.
S T. majus môžu súvisieť aj ďalšie biologické aktivity, ako sú antitrombínové a protizápalové aktivity, ochranné účinky na krv a pečeň proti toxicite dietylmaleátu a využitie jeho extraktov pri liečbe skorbutu.
Vzhľadom na rozšírené tradičné používanie T. majus, jej chemické zloženie, biologickú aktivitu a možnosť toxických účinkov počas tehotenstva môže byť opodstatnené ďalšie skúmanie liečivých vlastností rastliny.
Zdroj:
Boletín Latinoamericano y del Caribe de
Plantas Medicinales y Aromáticas
ISSN: 0717-7917
[email protected]
Universidad de Santiago de Chile
Chile